肌萎缩型颈椎病的临床特点及手术疗效分析
2014-11-20 文章来源:骨科在线 我要说
骨科在线版权所有,如需转载请注明来自本网站
【摘要】
研究背景:肌萎缩型颈椎病(Cervical SpondyloticAmyotrophy,CSA)是临床上一种较为少见的特殊类型颈椎病。目前的手术治疗方案包括:颈椎前路减压融合术、颈椎后路椎管成形伴或不伴椎间孔切开术。一些研究显示前路减压伴或不伴椎间孔切开,可以完全去除来自前方或侧前方的致压物,所以颈椎前路减压融合术是治疗肌萎缩型颈椎病临床较好的选择。该研究将对接受颈椎前路减压融合术治疗的肌萎缩型颈椎病患者进行回顾性分析。
材料与方法:对接受颈椎前路减压融合术的28例肌萎缩型颈椎病患者(近端型12例,远端型16例)进行临床与影像学评估。通过徒手肌力检查(Manual Muscle Testing, MMT)评估萎缩肌肉的肌力恢复情况,采用日本矫形外科协会(Japanese Orthopedic Association, JOA)评分评估患者的临床改善率,同时随访患者的患者满意度。
结果:91.7%的近端型CSA患者术后MMT获得1级或以上的肌力恢复,远端型CSA患者仅有37.5%(p<0.01)。JOA评分显示近端型和远端型CSA患者术后临床改善率分别为60.8%和41.8%(p<0.05),患者满意度分别为8.2和6.9(p<0.05)。术前病程与术后肌力恢复情况、JOA评分改善率及患者满意度均存在明显的相关性(p<0.05)。
结论:尽管远端型CSA患者的临床疗效明显差于近端型,但总体上颈椎前路减压融合术可以有效的提高CSA患者的临床功能。术前病程的长短是影响CSA患者手术疗效的重要因素,所以我们建议对于诊断明确的CSA患者尽早进行手术干预。
【关键词】肌萎缩;颈椎;颈椎前路减压融合术;颈椎病
引言
肌萎缩型颈椎病(Cervical SpondyloticAmyotrophy, CSA)是临床上一种较为少见的特殊类型颈椎病。其临床表现以明显的上肢肌肉萎缩为主要特征,可伴或不伴明显的感觉障碍和下肢症状。文献报道显示<7%的CSA患者可伴有轻微的感觉障碍【1,2】,而且CSA患者多为单侧症状,偶有双侧受累报道【3】。
根据主要受累肌群的不同,CSA可分为近端型和远端型。近端型CSA主要累及三角肌和肱二头肌,而远端型主要累及前臂肌肉和手内在肌【1】。虽然有报道认为CSA主要为选择性的脊髓前角或前根受累所致,但目前关于CSA的发病机制仍然存在一定争议【1】。
CSA的临床治疗措施包括保守治疗和手术干预。手术干预方案包括:颈椎前路减压融合术、颈椎后路椎管成形伴或不伴椎间孔切开术。一些研究显示前路减压伴或不伴椎间孔切开,可以完全去除来自前方或侧前方的致压物,所以颈椎前路减压融合术是治疗肌萎缩型颈椎病临床较好的选择【4,5】。临床上鉴别CSA与运动神经元病常存在一定的难度,因此中仅有少部分CSA患者接受了手术治疗【6】。而且目前CSA患者的手术疗效并不十分清楚。
该研究将对一组肌萎缩型颈椎病患者的临床特点与手术疗效进行回顾性分析。
资料与方法
2006年6月至2012年2月,于复旦大学附属华山医院骨科接受手术治疗的28例CSA患者(男性18例,女性10例)纳入该研究。我们采用的CSA诊断标准为:(1)颈椎存在退行性改变;(2)存在明显的单侧或双侧上肢肌肉萎缩;(3)不伴有或仅伴有轻微的上肢或下肢感觉障碍;(4)无明显的步态异常;(5)可伴有或不伴有上肢放射痛。同时临床上明确排除平山病和肌萎缩性脊髓侧索硬化症。
根据主要受累肌肉的不同,该组病例中近端型CSA 12例(受累肌肉主要为:肩胛带肌、三角肌与肱二头肌),远端型16例(受累肌肉主要为:肱三头肌、前臂肌与手内在肌);26例患者为单侧上肢受累(左、右侧各有13例),2例患者为双侧上肢受累。其中6例患者运动障碍之前存在肩部疼痛不适,但不伴有明显的感觉丧失。
我们采取以下措施进行临床评估:(1)肌电图(electromyography, EMG);(2)影像学检查;(3)徒手肌力检查(Manual Muscle Testing, MMT);(4)JOA评分改善率;(5)患者满意度。
1. EMG检查发现该组病例受累肌肉存在明显的失神经支配和动作电位降低,而椎旁肌
及下肢无明显异常。而且双侧正中神经和尺神经的感觉神经传导速度无明显异常。EMG结果提示病变部位为脊髓前角或前根【6】。
2. 影像学检查包括:颈椎X线片、颈椎CT平扫及二维重建、MRI。通过CT和MRI判断是否存在颈椎管狭窄(椎管前后径<14mm或MRT2加权像上蛛网膜下间隙消失)【5,7,8】。根据术前MRT2加权像横断面图像及术中发现前方压迫分为:中央型、旁中央型和椎间孔型【5】。根据MRT2加权像横断面及矢状位图像确定脊髓内是否存在高信号区【7,9】。根据MRT2加权像横断面图像判断萎缩最严重肌肉对应节段的脊髓前角和(或)前根受压情况【7】。根据影像学图像与EMG结果综合判断每一例患者的受压部位【7,10,11】。
3. 采用MMT评估主要受累肌肉手术前后的肌力。肌力改善分为四级:优:获得2级及以上恢复;良:获得1级恢复;中:获得部分恢复但低于1级;差:与术前比较没有任何恢复或加重。
4. 采用JOA评分改善率对术后临床功能进行评估。改善率的计算公式如下:(术后JOA评分-术前JOA评分)/(17-术前JOA评分)×100%
5. 患者满意度即患者主观上对手术总体效果的评估。采用0~10进行评估,即0和10分别表示最差和最好的结果。
该组病例术后1月、3月、6月、9月和12月进行常规临床随访。末次随访时分别记录肌力测定结果、JOA评分及患者满意度。采用MRI对临床节段退变进行评估。
因为前路完全去除前方致压物、而且较为安全,理论上可以获得较好的神经功能恢复,故该组病例均采用颈椎前路减压融合进行治疗。采用椎间盘切除或椎体次全切除的方式进行减压,术中去除手术节段椎间盘、软骨终板、钩突内侧部分、椎体后缘骨赘、突出的髓核组织及后纵韧带,以充分减压硬膜囊及脊髓前根。该研究经过复旦大学附属华山医院伦理委员会审核通过。所有患者均签署知情同意书。
统计学分析
该研究采用非配对t检验、卡方检验、单因素方差分析(ANOVA)、Pearson's相关分析及Spearman's相关分析进行统计学分析。取P<0.05存在统计学差异。所有统计学分析均采用SPSS 18.0(IBM SPSS, NY, USA)进行分析。
结果
该组病例术前平均年龄55.9岁(38-69岁),术后平均随访时间为26.6个月(8-75个月),术前平均病程为12.3个月(1-60个月)。末次随访证实该组病例均获得植骨融合,未见内植物松动或移位。近端型患者(受累肌肉主要为:肩胛带肌、三角肌与肱二头肌)术前肱二头肌腱反射减弱或正常,而远端型患者(受累肌肉主要为:肱三头肌、前臂肌与手内在肌)术前肱三头肌腱反射减弱或正常。该组病例术后均接受MRI检查,仅有1例患者发生明显的影像学邻近节段退变但不伴有对应的任何临床不适症状。
表1. 对近端型和远端型CSA患者的临床特点及手术疗效进行了总结。由此我们可以发现:
近端型CSA最常受累节段为C4-5,依次为C5-6、C3-4,而远端型CSA最常受累节段为C5-6,依次为C6-7、C4-5、C3-4。萎缩最严重肌肉对应节段通常为2节段,近端型多为C4-5和C5-6,而远端型多为C5-6和C6-7(P<0.01)。
CSA多为脊髓前角和(或)前根受累所致(图1A.)。前角和前根受累的患者数量分别为17例和9例,而存在2例患者表现为前角和前根同时受累。前角受累患者与前根受累患者术前病程(P=0.176)、术后肌力恢复优良率(P=0.517)、JOA评分改善率(P=0.068)及患者满意度(P=0.214)均无明显统计学差异。
近端型和远端型CSA患者均采用MRT2加权像分析脊髓内高信号区及椎管狭窄情况。结果显示两者患者脊髓内高信号区发生率并无统计学差异。
近端型和远端型CSA患者术后JOA评分改善率分别为60.8%和41.8%(p<0.05),患者满意度分别为8.2和6.9(p<0.01)。91.7%的近端型CSA患者术后MMT获得1级或以上的肌力恢复,而远端型CSA患者仅有37.5%(p<0.01)。尽管近端型CSA患者的术后随访时间明显短于远端型(p<0.05)(表 1.),但我们却发现近端型CSA患者在JOA评分改善率、患者满意度及肌力恢复方面均优于远端型CSA患者(图 1B.)。
表1: 近端型和远端型两组患者的比较 | |||
参数 | 组别1 (近端型) (%) | 组别2 (远端型) (%) | P值 |
病例数 | 12 | 16 | / |
平均年龄(岁) | 56.3±10.6 | 55.6±7.7 | NS |
平均病程(月) | 10.9±10.2 | 13.3±16.3 | NS |
平均随访时间(月) | 18.0±10.3 | 33.1±17.3 | 0.013* |
JOA评分改善率 | 0.608±0.175 | 0.418±0.259 | 0.029* |
患者满意度 | 8.2±1.1 | 6.9±1.0 | 0.003* |
肌力恢复情况 |
|
| 0.006& |
优和良病例数及比例 | 11 (91.7) | 6 (37.5) | - |
中和差病例数及比例 | 1 (8.3) | 10 (62.5) | - |
受累节段 |
|
| 0.008& |
C3-C4+C4-C5 | 2 (16.7) | 0 (0) | - |
C3-C4+C4-C5+C5-C6 | 0 (0) | 1 (6.3) | - |
C4-C5 | 3 (25) | 0 (0) | - |
C4-C5+C5-C6 | 6 (50) | 2 (12.5) | - |
C4-C5+C5-C6+C6-C7 | 0 (0) | 2 (12.5) | - |
C5-C6 | 1 (8.3) | 2 (12.5) | - |
C5-C6+C6-C7 | 0 (0) | 7 (43.8) | - |
C6-C7 | 0 (0) | 2 (12.5) | - |
受损部位 |
|
| NS |
AH | 6 (50) | 11 (68.8) | - |
VNR | 4 (33.3) | 5 (31.3) | - |
AH+VNR | 2 (16.7) | 0 (0) | - |
MRT2HIZ | 3/12 (25) | 6/16 (37.5) | NS |
椎管狭窄病例数 | 8/12 (66.7) | 11/16 (68.8) | NS |
*非配对t检验&卡方检验. NS=无统计学意义, AH=前角, VNR=前根, HIZ=高信号区, MRT2=磁共振T2加权像, JOAs=日本矫形外科协会评分 | |||
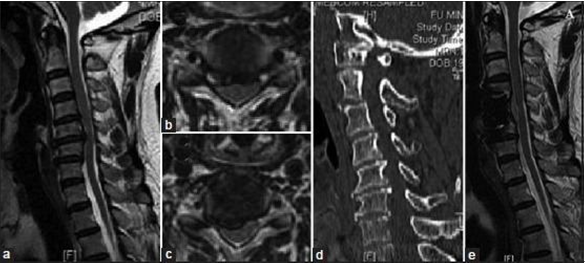
图1 A. 男性,41岁,诊断为近端型CSA,并接受颈椎前路减压融合术。(a)MRT2矢状位图像显示C4-5、C5-6节段脊髓受压;(b)MRT2横断面显示C4-5节段脊髓前方中央型受压;(c)MRT2横断面显示C5-6节段脊髓前角受损;(d)CT矢状位二维重建提示颈椎管伴有狭窄;(e)术后1年MRT2图像,椎体次全切除区域脊髓获得充分减压,其他节段也无任何压迫。
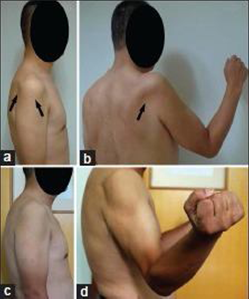
图1 B. 该病例的临床外观照片。(a)右侧冈下肌和三角肌明显萎缩;(b)患者术前右侧肩关节不能抗重力完全外旋和外展;(c)术后1年萎缩的冈下肌和三角肌较术前明显饱满;(d)颈椎前路减压融合术后1年右肩关节可以进行完全外旋、外展。
肌力恢复情况
该例病例肌力恢复情况如下,优:6例(21.4%);良:11例(39.3%);中:9例(32.1%);差:2例(7.1%)。这四组患者在术前病程、JOA改善率及患者满意度方面均存在明显的统计学差异(p<0.01)(表 2.)。另外,MRT2加权像脊髓内高信号区发生率及神经受累部位方面不存在明显差异。结果表明肌力恢复情况与术前病程的长短密切相关,而与脊髓内是否存在高信号区无明确相关性。术前病程越短,术后可以获得较好的肌力恢复、较好的JOA评分改善率和患者满意度(图2.)。
表2: 不同肌力恢复情况的临床特点及手术疗效 | |||||
参数 | 优(%) | 良 (%) | 中 (%) | 差 (%) | P值 |
病例数 | 6 (21.4) | 11 (39.3) | 9 (32.1) | 2 (7.1) | |
平均年龄(岁) | 59.5±10.5 | 57.4±8.2 | 52.2±8.7 | 53.5±7.8 | NS |
平均病程(月) | 6.6±4.5 | 6.8±6.9 | 16.2±13.8 | 42.0±25.5 | 0.001* |
平均随访时间(月) | 19.0±11.4 | 28.3±19.1 | 32.0±15.9 | 16.0±4.2 | NS |
JOA评分改善率 | 0.689±0.191 | 0.582±0.129 | 0.383±0.205 | 0.000* | |
患者满意度 | 8.3±1.4 | 7.8±0.8 | 6.9±1.1 | 5.5±0.7 | 0.007* |
MRT2 HIZ | 2 (33.3) | 2 (18.2) | 4 (44.4) | 1 (50) | NS |
不同受损部位病例数 | NS | ||||
AH | 3 (50) | 7 (63.6) | 5 (55.6) | 2 (100) | - |
VNR | 2 (33.3) | 4 (36.4) | 3 (33.3) | 0 (0) | - |
AH+VNR | 1 (16.7) | 0 (0) | 1 (11.1) | 0 (0) | - |
*单因素方差分析. NS=无统计学意义, AH=前角, VNR=前根, HIZ=高信号区, MRT2=磁共振T2加权像, JOAs=日本矫形外科协会评分 | |||||
多因素分析
我们发现MRT2加权像脊髓内是否存在高信号区与神经受累部位存在一定相关性,但与肌力恢复情况、JOA评分改善率及患者满意度无明显相关性。同时,我们发现肌力恢复情况、JOA评分改善率及患者满意度与术前病程密切相关(p<0.05)。这提示术前病程的长短是影响CSA患者手术预后的重要因素(表3)。

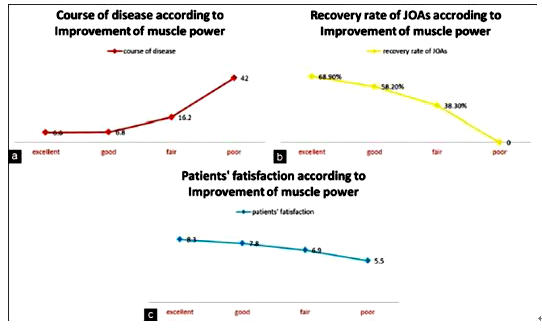
图2.肌力恢复情况(a)、JOA评分改善率(b)和患者满意度与术前病程均密切相关。
讨论
CSA是临床上一种较为少见的特殊类型颈椎病,其临床表现以明显的上肢肌肉萎缩为主要特征,一般不伴有明显的感觉障碍和髓性症状【2】。CSA患者受累上肢多为单侧,偶有双侧受累报道【3】。该研究中仅有2例患者为双侧上肢受累;6例患者术前存在肩部疼痛症状,而术后消失。我们推测该疼痛症状源自硬膜或神经根袖刺激,而非后根【11】。
关于CSA发病机制是脊髓前角还是前根受累的争议一直存在。一些学者归因于侧后方骨赘对前根(腹侧运动根)的选择性压迫,而另外一些学者认为脊髓前动脉的血供不足导致脊髓前角区域发生选择性损伤【1】。Fujiwara等【7】认为远端型CSA主要为前角受损所致,而非单纯前根受累。恰恰相反,Imajo等【2,12】却认为CSA的病理机制为前角与前根的同时受累。根据本研究中EMG和MRT2加权像的分析结果,我们认为无论前角还是前根受损均可导致CSA。
多项研究显示近端型CSA主要受累节段为C4-5,而远端型为C5-6【1,5,13】。几位学者认为由于动态压迫导致的脊髓血供不足将导致多节段的前角细胞受损【7,9,12,14,15】。假定最初的损伤来自缺血而非压迫,那么我们可以认为脊髓前动脉及分支动脉周围的轻微退变即可导致较为严重的节段性前角缺血性损伤【1,15】。该研究中我们同样证实近端型和远端型最常受累节段分别为C4-5、C5-6。然后我们发现萎缩最严重肌肉常常对应于两个节段,如近端型多为C4-5和C5-6,远端型则为C5-6和C6-7。12例近端型CSA患者中8例(66.7%)存在椎管狭窄,而16远端型患者11例(68.8%)存在椎管狭窄。因此,我们认为CSA的病理机制为脊髓多节段动态压迫导致的前角或前根受损。
既往研究表明前路减压融合术是治疗CSA的有效手术方案。然后,手术疗效的影响因素并不清楚。Shinomiya等【11】证实对于保守治疗无效的所有近端型CSA患者前路减压融合可以取得较为理想的临床疗效。而且,前根受累患者的临床效果优于前角受累患者。Uchida等【5】研究显示,对于近端型CSA患者,较长的术前病程和脊髓中央受压与较差的肌力恢复存在一定相关性。
通过该研究我们发现近端型CSA在肌力恢复情况、JOA评分改善率及患者满意度等方面均优于远端型。Fujiwara等【7】的一项研究发现,92%的近端型CSA患者术后可获得明显的肌力恢复,而远端型该数值仅为38%。然而,我们并没有发现两组患者在病程与MRT2加权像脊髓内高信号区发生率方面存在明显差异。然而,Inui等【16】研究发现不同的CSA类型和压迫部位手术疗效并没有统计学差异。Fujiwara等将此现象归因为远端型主要为脊髓前角受损,而脊髓前角细胞的再生或恢复能力远低于前根。该组病例中虽然远端型患者前角受累的比例略高于近端型,但两者并无明显的统计学差异。一种可能解释为远端型CSA脊髓至萎缩肌肉的距离远长于近端型。因此,近端型CSA患者可以获得较为明显的肌力恢复,从而具有较好的临床改善率和较高的患者满意度【7】。
尽管既往研究对手术疗效不良的危险因素进行探讨,但该问题仍充满争议。研究表明MRT2加权像的脊髓内高信号及MRT1加权像的脊髓内低信号意味着脊髓局部水肿、脊髓软化以及胶质细胞增生等病理改变,常提示脊髓发生了不可逆性改变。有研究认为这种改变与CSA患者术后恢复不良密切相关【17】。Fujiawara等【7】曾报道远端型CSA的手术疗效明显差于近端型,他们认为临床病例数量较少、具有较长的术前病程、多节段椎管狭窄以及MRT2加权像上脊髓内高信号发生率高是远端型CSA患者的临床特点。在我们的该项研究中,我们并未发现MRT2加权像上脊髓内高信号与术后疗效不良存在明确相关性。Uchida等【5】的研究也未发现两者之间存在相关性。该研究进一步证实MRT2加权像上脊髓内高信号并不能对手术疗效或临床预后进行确切的预测。一般来说,脊髓内异常信号常提示脊髓受压时间较长【18】。Tauchi等【19】曾报道脊髓型颈椎病患者中脊髓内信号异常常发生于脊髓中央区域。而CSA患者的神经受压或受损部位一般为脊髓前角或前根。由此也许可以解释CSA患者脊髓内异常信号与术后疗效不良无明显相关性的原因所在。
进一步研究,我们发现MRT2加权像上脊髓内高信号区与前角或前根的部位存在一定的相关性。脊髓前角位于沟动脉的终末支供血区域,当循环障碍时易于发生损伤【1】。Wada等【20】研究证实MRT2加权像上多节段脊髓内高信号改变(线性高信号)为前角细胞广泛损伤的临床证据以及灰质发生空洞、坏死的影像学表现。
Uchida、Inui等和Tauchi等【5,6,19】研究中均指出术前病程长短与肌力恢复密切相关,但具体的内在关系并未进行探讨。在该研究中,我们不仅再次证实病程长短与肌力恢复存在相关性,而且进一步发现术前病程是CSA两种临床亚型术后疗效不良的唯一危险因素。术前病程越短,术后肌力恢复越好,而且JOA评分改善率及患者满意度越高。因此,我们建议对于CSA患者的保守治疗时间不要过长,否则可能会丧失最佳的手术干预时机。我们建议对于诊断明确的CSA患者尽早进行手术干预。
该研究尚存在一定的不足。首先,该研究样本量较小,导致分析手术疗效不良危险因素的统计学效能可能不足。其次,该研究为一项回顾性病例分析,并没有其他治疗对照组。然而,该研究中我们采用JOA评分和患者满意度等客观性指标和主观性指标进行手术疗效评估,这在先前的研究中较少采用。
结论
尽管远端型CSA患者的临床疗效明显差于近端型,但总体上颈椎前路减压融合术可以有效的提高CSA患者的临床功能。术前病程的长短是影响CSA患者手术疗效的重要因素,所以我们建议对于诊断明确的CSA患者尽早进行手术干预。
1. Jiang SD, Jiang LS, Dai LY. Cervical spondyloticamyotrophy. EurSpine J 2011;20:351-7.
2. Imajo Y, Kato Y, Kanchiku T, Suzuki H, Taguchi T. Pathology andprognosis of proximal-type cervical spondyloticamyotrophy: New assessment usingcompound muscle action potentials of deltoid and biceps brachii muscles. Spine(Phila Pa 1976) 2011;36:E476-81.
3. Gebere-Michael SG, Johnston JC, Metaferia GZ, Wuhib MZ,Fernandez HH. Bilaterally symmetric cervical spondyloticamyotrophy: A novelpresentation and review of the literature. J NeurolSci 2010;290:142-5.
4. Saringer W, Nöbauer I, Reddy M, Tschabitscher M, Horaczek A.Microsurgical anterior cervical foraminotomy (uncoforaminotomy) for unilateralradiculopathy: Clinical results of a new technique. ActaNeurochir (Wien)2002;144:685-94.
5. Uchida K, Nakajima H, Yayama T, Sato R, Kobayashi S, Kokubo Y, etal. Anterior and posterior decompressive surgery for progressive amyotrophyassociated with cervical spondylosis: A retrospective study of 51 patients. JNeurosurg Spine 2009;11:330-7.
6. Kaneko K, Taguchi T, Toyoda K, Kato Y, Azuma Y, Kawai S.Distal-type cervical spondyloticamyotrophy: Assessment of pathophysiology fromradiological findings on magnetic resonance imaging and epidurally recordedspinal cord responses. Spine (Phila Pa 1976) 2004;29:E185-8.
7. Fujiwara Y, Tanaka N, Fujimoto Y, Nakanishi K, Kamei N, Ochi M.Surgical outcome of posterior decompression for cervical spondylosis withunilateral upper extremity amyotrophy. Spine (Phila Pa 1976) 2006;31:E728-32.
8. Tanaka N, Fujimoto Y, Yasunaga Y, Ochi M. Functional diagnosisusing multimodal spinal cord evoked potentials in cervical myelopathy. JOrthopSci 2005;10:3-7.
9. Shibuya R, Yonenobu K, Yamamoto K, Kuratsu S, Kanazawa M, OnoueK, et al. Acute arm paresis with cervical spondylosis: Three casereports. SurgNeurol 2005;63:220-8.
10. Tanaka N, Fujimoto Y, An HS, Ikuta Y, Yasuda M. The anatomicrelation among the nerve roots, intervertebral foramina, and intervertebraldiscs of the cervical spine. Spine (Phila Pa 1976) 2000;25:286-91.
11. Shinomiya K, Komori H, Matsuoka T, Mutoh N, Furuya K.Neuroradiologic and electrophysiologic assessment of cervicalspondyloticamyotrophy. Spine (Phila Pa 1976) 1994;19:21-5.
12. Imajo Y, Kato Y, Kanchiku T, Suzuki H, Yoshida Y, Funaba M, etal. Prediction of surgical outcome for proximal-type cervicalspondyloticamyotrophy novel mode of assessment using compound action potentialsof deltoid and biceps brachii and central motor conduction time. Spine (PhilaPa 1976) 2012;37:E1444-9.
13. Zhang JT, Yang da L, Shen Y, Zhang YZ, Wang LF, Ding WY.Anterior decompression in the management of unilateral cervicalspondyloticamyotrophy. Orthopedics 2012;35:e1792-7.
14. SrinivasaRao NV, Rajshekhar V. Distal-type cervicalspondyloticamyotrophy: Incidence and outcome after central corpectomy. JNeurosurg Spine 2009;10:374-9.
15. Ahdab R, Créange A, Benaderette S, Lefaucheur JP. Cervicalspondyloticamyotrophy presenting as dropped head syndrome. ClinNeurolNeurosurg2009;111:874-6.
16. Inui Y, Miyamoto H, Sumi M, Uno K. Clinical outcomes andpredictive factors relating to prognosis of conservative and surgicaltreatments for cervical spondyloticamyotrophy. Spine (Phila Pa 1976)2011;36:794-9.
17. Yagi M, Ninomiya K, Kihara M, Horiuchi Y. Long-term surgicaloutcome and risk factors in patients with cervical myelopathy and a change insignal intensity of intramedullary spinal cord on Magnetic Resonance imaging. JNeurosurg Spine 2010;12:59-65.
18. Uchida K, Nakajima H, Sato R, Kokubo Y, Yayama T, Kobayashi S, etal. Multivariate analysis of the neurological outcome of surgery forcervical compressive myelopathy. J OrthopSci 2005;10:564-73.
19. Tauchi R, Imagama S, Inoh H, Yukawa Y, Kanemura T, Sato K, etal. Risk factors for a poor outcome following surgical treatment ofcervical spondyloticamyotrophy: A multicenter study. Eur Spine J2013;22:156-61.
20. Wada E, Ohmura M, Yonenobu K. Intramedullary changes of thespinal cord in cervical spondylotic myelopathy. Spine (Phila Pa 1976)1995;20:2226-32.
(王洪立 姜建元 李恒超 吕飞舟 陈文钧 马晓生
复旦大学附属华山医院骨科复旦大学脊柱外科中心,200040,上海
通讯作者:姜建元,E-mail:jjy@fudanspine.com)
表3: 手术疗效多因素分析 | |||||
参数 | MRT2 HIZ | JOA评分改善率 | 患者满意度 | 肌力恢复情况 | |
受损部位 | rs=−0.543 | NS | NS | NS | |
P=0.003& | |||||
术前病程 | NS | r=−0.662 | r=−0.416 | rs=−0.391 | |
P=0.000* | P=0.028* | P=0.040& | |||
患者满意度 | NS | r=0.585 | NS | rs=0.399 | |
P=0.001* | P=0.036& | ||||
肌力恢复情况 | NS | rs=0.443 | NS | NS | |
P=0.018& | *Pearson's相关分析, &Spearman's相关分析. NS=无统计学意义, HIZ=高信号区, MRT2=磁共振T2加权像, JOAs=日本矫形外科协会评分 | ||||


 京公网安备11010502051256号
京公网安备11010502051256号