力学刺激与半月板
2017-05-11 作者:北京大学第三医院骨科 牛国栋 冷慧杰 点击量:568 我要说
半月板是膝关节中极其重要的解剖结构,由两个月牙形的纤维软骨构成,分别位于胫骨平台内外两侧的关节面,内侧成“C”型,外侧为“O”型。半月板是由纤维软骨组织组成,其对于膝关节中的力学负荷的传递和分布起到关键作用。半月板复杂的几何形状、超微结构和组织组成成分决定了其独特性质。半月板主要由胶原构成的细胞外基质,在软骨内主要是II型胶原,而在外部主要是纤维性的I型胶原。半月板的组成和结构,通过其上的纤维软骨细胞的合成和分解代谢活动来维持。半月板纤维软骨细胞的生物活动不仅仅由生长因子、细胞因子等基因和生化因素控制,还同时受到与关节负荷相关的物理性因素的调节[1-4]。
力学因素在半月板的发育、维持、降解和修复中所起的作用不可忽视。许多研究以半月板组织块为研究对象,评估了力学加载条件对半月板细胞在原始细胞外基质中的效应。对半月板组织块进行力学加载调控主要体现在应变和施加载荷的幅度、频率以及施加的载荷的形式的调控。在动态加载时,10%范围的应变对半月板有促进合成代谢的倾向,但在20%的加载幅度,则转换为促进分解代谢的作用[5,6]。以10%的生理性应变及1Hz频率加载2个小时,会抑制促炎介质NO的释放,并能增强聚集蛋白聚糖的基因表达,但也增加了分解代谢性基因COX2和ADAMTS-5的表达[7-9]。然而,20%的高应变幅度会诱导病理性反应,包括MMP-1、MMP-3、MMP-13和ADAMTS-4等表达的上调。但I型胶原、TIMP-1、TGF-β等,在对半月板组织块动态加载过程中,从0%变形到20%变形,没有发生显著变化。除了对半月板组织块进行生理性应变加载的研究外,也有过度加载的研究。对不成熟的小牛半月板施加一个40%的应变,并选择不同的应变速率(0.5%,5%,50%),只诱导出了生物性变化,而没有发现物理性变化或者半月板组成成分的变化[10]。对半月板内侧区域进行过度加载(单次的50%的应变,100%应变/秒)引起组织表面大范围的细胞死亡,但是未出现组织的损伤以及分解代谢和促炎因子基因表达的下调[11]。

(a)
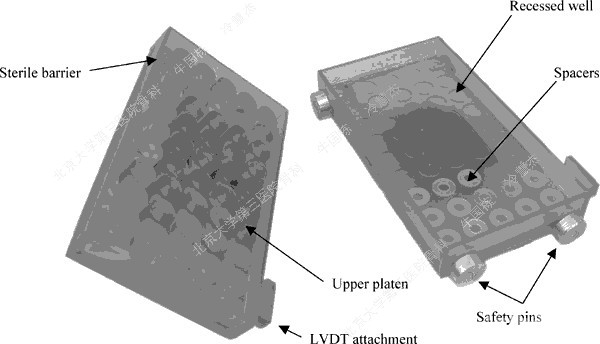
(b)
图1.(a)软骨及半月板组织块压缩加载示图 (b)加载腔室示意图[7]
半月板组织块水平的研究初步揭示了力学刺激跟炎症的互动关系。通过分离培养的半月板软骨细胞,可以研究半月板力学生物学特异性的下游信号通路。在以15%的应变动态牵拉半月板纤维软骨细胞时,会抑制IL-1β引起的诱导型一氧化氮合酶、MMP-13和TNF-α上调[12]。值得注意的是,这些效应是频率依赖性的,高频更能有效地抑制IL-1介导的分解代谢反应。另外,力学刺激的抗分解代谢效应在力学加载完成后在IL-β依然存在的情况下持续了24个小时,意味着我们可能可以利用生物力学信号通路的激活去阻断关节损伤或关节炎时慢性炎症的分解代谢效应。
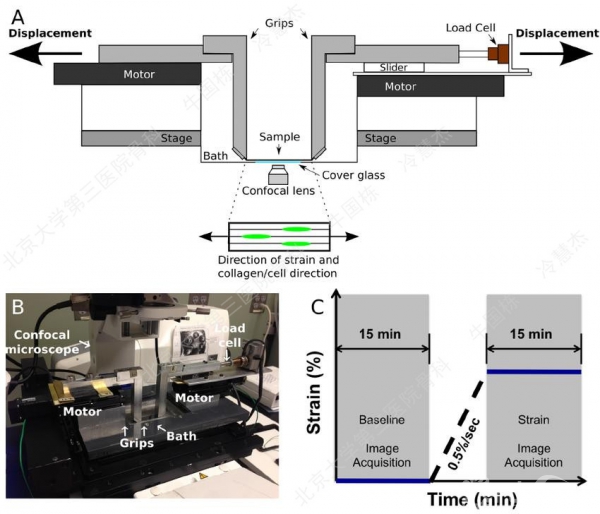
图2 半月板纤维滑膜细胞加载方案及观察示意图[12]。
尽管半月板细胞的力学生物学效应已成为研究热点之一,但涉及其中的力学传导机制仍然不是很清楚,有待进一步研究解释。研究者选择力学传导通路大的是基于从其他软骨性细胞的发现中推断而来的,例如软骨细胞等。往复流体产生的剪切力作用下(0-6.5Pa)可以引起兔半月板细胞内Ca2+和sGAG产量的升高。Ca2+信号有响应的半月板细胞比例与施加的力学刺激正相关;用毒胡萝卜素处理后,Ca2+信号和sGAG产量均被抑制,说明力学刺激诱导的Ca2+信号通路可能调节半月板细胞外基质的合成。然而,负责感受力学刺激的转运体或受体以及如何将Ca2+转运入胞内还不是很清楚。最新的技术进展允许在微力学加载的情况下在共聚焦显微镜下实时评估Ca2+信号。分别对小牛半月板周边区域原位细胞、附着在支架上的半月板细胞以及种植于硅胶膜上的半月板细胞,施加一个0-9%的应变力,发现只有在原位半月板上的半月板细胞有Ca2+信号峰值的增加,而在其他两种介质上没有变化。
半月板对于关节组织的运动稳定性和炎症发生发展都非常重要,而力学刺激更是其中重要的调节因素。力学刺激是一把双刃剑,其在任何组织细胞中的作用和机制都是极复杂的,对于半月板和其上细胞也不例外。我们这里总结的内容只是冰山一角,还有很多的结果和问题值得挖掘和探讨,这样我们才能更明白负荷对于关节健康之间的作用。
参考文献
[1] COLLIERS, GHOSH P. Effects of transforming growth factor beta onproteoglycan synthesis by cell and explant cultures derived from the knee jointmeniscus[J]. Osteoarthritis Cartilage, 1995, 3(2): 127-38.
[2] MCNULTYA L, ROTHFUSZ N E, LEDDY H A, et al. Synovial fluidconcentrations and relative potency of interleukin-1 alpha and beta incartilage and meniscus degradation[J]. J Orthop Res, 2013, 31(7):1039-45.
[3] PANGBORNC A, ATHANASIOU K A. Effects of growth factors on meniscalfibrochondrocytes[J]. Tissue Eng, 2005, 11(7-8): 1141-8.
[4] RIERAK M, ROTHFUSZ N E, WILUSZ R E, et al. Interleukin-1, tumor necrosisfactor-alpha, and transforming growth factor-beta 1 and integrative meniscalrepair: influences on meniscal cell proliferation and migration[J]. ArthritisRes Ther, 2011, 13(6): R187.
[5] GUPTAT, ZIELINSKA B, MCHENRY J, et al. IL-1 and iNOS gene expression and NOsynthesis in the superior region of meniscal explants are dependent on themagnitude of compressive strains[J]. Osteoarthritis Cartilage, 2008, 16(10):1213-9.
[6] ZIELINSKAB, KILLIAN M, KADMIEL M, et al. Meniscal tissue explants response depends onlevel of dynamic compressive strain[J]. Osteoarthritis Cartilage, 2009, 17(6):754-60.
[7] AUFDERHEIDEA C, ATHANASIOU K A. A direct compression stimulator for articular cartilageand meniscal explants[J]. Ann Biomed Eng, 2006, 34(9): 1463-74.
[8] NISHIMUTAJ F, LEVENSTON M E. Response of cartilage and meniscus tissue explants to invitro compressive overload[J]. Osteoarthritis Cartilage, 2012, 20(5): 422-9.
[9] KISIDAYJ D, VANDERPLOEG E J, MCILWRAITH C W, et al. Mechanical injury of explants fromthe articulating surface of the inner meniscus[J]. Arch Biochem Biophys, 2010,494(2): 138-44.
[10] FERRETTIM, MADHAVAN S, DESCHNER J, et al. Dynamic biophysical strain modulatesproinflammatory gene induction in meniscal fibrochondrocytes[J]. Am J PhysiolCell Physiol, 2006, 290(6): C1610-5.
[11] EIFLERR L, BLOUGH E R, DEHLIN J M, et al. Oscillatory fluid flow regulatesglycosaminoglycan production via an intracellular calcium pathway in meniscalcells[J]. J Orthop Res, 2006, 24(3): 375-84.
[12] HANW M, HEO S J, DRISCOLL T P, et al. Impact of cellular microenvironment andmechanical perturbation on calcium signalling in meniscus fibrochondrocytes[J].Eur Cell Mater, 2014, 27: 321-31.


 京公网安备11010502051256号
京公网安备11010502051256号