新研究,具有“外源-内源”共诱导的微纳米纤维基人工骨膜能够促进骨折愈合
2019-11-03 文章来源:陈亮 崔文国 我要说
研究内容
尽管目前外科技术以及植骨材料研究飞速发展,骨折延迟愈合甚至不愈合,在临床工作中仍旧是一个很大的挑战。以往人们过多的关注于骨缺损本身,而忽略了骨膜的重要性及其在骨科疾病发生发展时的易损性,因而大量治疗方案始终围绕于骨移植物来研究和开展。作为正常骨组织的重要组成成分,骨膜在骨的发育和损伤修复中起着至关重要的作用。
骨膜起源于中胚层的间充质,在胚胎发育过程中,间充质先浓缩聚集形成软骨雏形和一层包绕其上的软骨纤维膜。随着软骨膜的血管化,间充质细胞增生并向成骨细胞方向分化,逐渐形成一层包绕软骨雏形的被称作骨领的原始骨组织。随着骨领的形成,软骨膜改称为骨膜。显然,骨膜的发育过程是一个协调而有序的过程。受启发于骨膜发育的阶段性,结合其结构和功能的特点,作者设想构建一个能够模拟天然骨膜发育过程的纤维膜来替代骨膜,从而使骨膜的重建以及骨的修复更自然、温和。
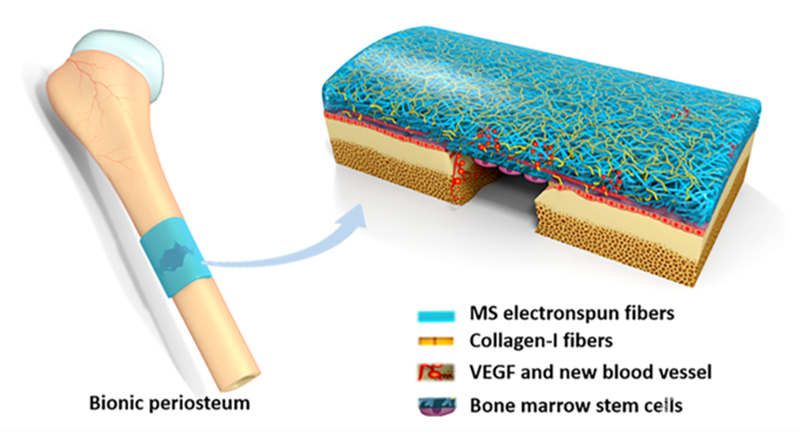
图1:人工骨膜的应用及作用机制示意图
对于理想的骨膜纤维层而言,需要满足的要求包括:良好的生物相容性能促进间充质细胞的黏附与增殖,良好的血管化能力以满足细胞和骨组织代谢的需要和生长因子的传递,相似的细胞外环境来诱导细胞的成骨分化,以及当骨缺损髓腔暴露时有一定的物理强度能保护骨组织的内外环境稳定。
在这项研究中,作者以骨膜发育的阶段性过程为启发,成功构建了VEGF介导的可血管化的微纳米纤维膜作为外源性人工骨膜的纤维层。通过微溶胶静电纺丝技术,VEGF被负载于透明质酸(HA)-PLLA核壳结构纤维的内部,以缓慢释放的方式诱导纤维膜和骨缺损区域的早期血管化。同时,自组装胶原纤维和PLLA纤维共同构建的等级性微纳米结构极大的模拟了细胞外微环境,不仅保护了骨髓腔内外环境的稳定性,也为细胞粘附、增殖和分化提供了结构和生物学方面的因素。
体内研究从结构与形态学角度证实了仿生骨膜能够诱导内源性生发层成骨细胞的形成,从而完成外源-内源相结合的骨膜修复过程。而其再生组织中骨膜蛋白(Periostin)的高聚集线性表达,进一步从分子角度阐释了骨膜再生机制。
最后,人工骨膜能以骨膜固有的成骨机制促进骨缺损快速而均匀的修复。此人工骨膜既能单独使用,也能够联合现有的优秀植骨材料,同时关注于骨膜和骨缺损两个方面,以期实现降低临床骨缺损骨不连机率的目的。
该研究通过再生医学纤维膜的材料学属性模拟正常骨膜的发育过程,实现骨膜与骨的结构和功能再生,为临床治疗提供了新的思路。
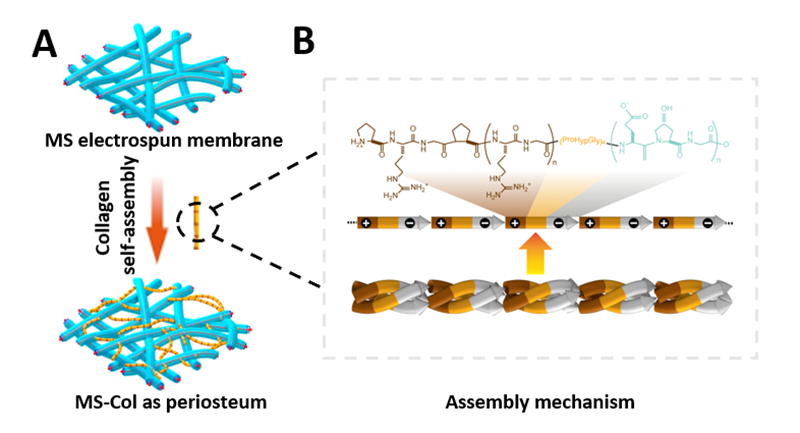
图2:人工骨膜的构建流程。(A)微溶胶静电纺丝及胶原自组装示意图和(B)胶原自组装机制示意图
论文第一作者为吴亮、顾勇和刘立立,苏州大学附属第一医院陈亮教授和上海交通大学附属瑞金医院/上海市伤骨科研究所崔文国教授为该文章的共同通讯作者,该研究还得到上海交通大学附属瑞金医院/上海市伤骨科研究所邓廉夫教授参与和指导。
课题组简介
陈亮:主任医师/教授/博导,苏州大学附属第一医院脊柱外科学术带头人,苏州市骨科生物活性材料重点实验室负责人,致力于脊柱外科基础与临床,骨组织工程等方面的研究。以第一或通讯作者身份发表SCI、中华医学会等期刊100余篇。荣获国家科技进步二等奖1次,省部级奖项8项,市厅级16项。主持国家重点研发计划,国家自然科学基金,省部级课题10余项。现任江苏省医学会骨科学分会副主任委员,江苏省康复医学会脊柱脊髓损伤委员会副主任委员,SICOT中国部青年学会副主任委员,中华医学会骨科学分会青年委员和脊柱学组委员,华裔脊柱外科学会理事,中国脊柱脊髓损伤专业委员会青年委员,江苏省“333”工程第二层次,十三五“科教强卫”医学重点人才,“六大人才高峰行动计划”。
崔文国:教授/博导,上海交通大学附属瑞金医院/上海市伤骨科研究所。主要基于转化生物医用材料,从事骨组织工程与骨、关节修复重建的研究。以第一/通讯作者发表SCI论文90余篇(IF>10的20余篇),引用5000多次,H=37,专利40多项,主编Elsevier书籍1本。主持国家自然科学基金项目重点项目、面上项目等各类课题10项,曾获中组部国家“万人计划”青年拔尖人才等人才计划支持。
基金资助
该研究得到了国家自然科学基金委(81772312、81601891和51873107),国家重点研发计划(2016YFC1101505、2018YFC1106204)等项目支持。
论文信息
Liang Wu#, Yong Gu#, Lili Liu#, Jingcheng Tang, Jiannan Mao, Kun Xi, Zhirong Jiang, Yidi Zhou, Yun Xu, Lianfu Deng, Liang Chen*, Wenguo Cui*. Hierarchical micro/nanofibrous membranes of sustained releasing VEGF for periosteal regeneration. Biomaterials 2020, 227, 119555.


 京公网安备11010502051256号
京公网安备11010502051256号