骨巨细胞瘤治疗新突破——狄诺塞麦
2015-05-04 文章来源:许宋锋 Brock Adams 于秀淳 徐明 我要说
摘要 骨巨细胞瘤(GCTB)是一种富含巨细胞的侵袭性、溶骨性病变,特征为大量多核破骨细胞样巨细胞聚集、表达细胞核因子kB受体活化因子配体(RANKL),目前还没有一种方法可彻底有效治愈,尤其是对无法手术的GCTB。近年文献报道在进行性或无法手术的GCTB患者中使用狄诺塞麦(denosumab),可观察到肿瘤成分明显改变、骨破坏减少及临床有效性。狄诺塞麦是一种人RANKL单克隆抗体,与核因子kB受体活化因子(RANK)结合具有很高的亲和性和特异性。以往很多大规模Ⅲ期试验研究已表明,狄诺塞麦在降低各种肿瘤引起的骨破坏方面明显优于二磷酸盐,还可延缓骨转移出现。该文对相关文献进行回顾,并就狄诺塞麦在GCTB治疗中存在的问题进行探讨。
关键词 狄诺塞麦;骨巨细胞瘤;核因子kB受体活化因子配体;骨转归
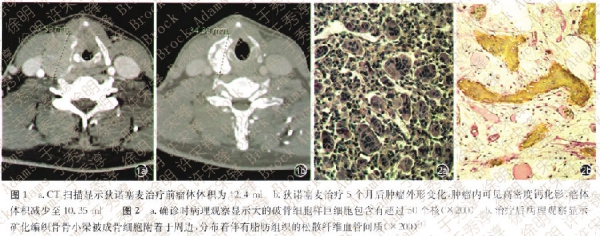
2013年1月,Derbel等[1]报道1例38岁男性甲状软骨骨巨细胞瘤(GCTB)患者经治疗后成功痊愈的消息。该患者最初是按照甲状腺癌治疗,后来接受细胞核因子KB受体活化因子配体(RANKL)抑制剂狄诺塞麦(denosumab)治疗3个月,结果CT扫描显示病变显著改善,有超过50%肿瘤体积的多处钙化(图1);手术后病理检查见肿瘤内明显成骨、(ETB完全消失(图2)。此个案提示采用狄诺塞麦治疗GCTB可以获得彻底的病理学治愈。
狄诺塞麦是否真的实现了GCTB治疗的突破?本文就狄诺塞麦与GCTB相关研究及狄诺塞麦应用前景的一些思考作一回顾性分析。
1 GCIB
GCTB是一种富含巨细胞的骨病变,特征是出现大量多核破骨细胞样巨细胞。此类问充质肿瘤包含大量多核巨细胞瘤,单核基质细胞是肿瘤细胞[2]。这些巨细胞经研究证明表达RANKL,也是肿瘤侵袭性骨损害的原因[3]。总的看,GCTB为良性病变,但不典型性GCTB呈现复发多样性、多部位、肺转移或因导致功能异常而不易切除[4]。因此,世界卫生组织将GCTB定义为“侵袭性潜在恶性病变”[5]。
在美国,GCTB占所有原发骨肿瘤的5%、所有成人良性骨肿瘤的20%[6];在英国,每年有50~60例新发病例需要治疗[7];在中国和印度,GCTB更常见,大约占所有原发骨肿瘤的20%[5]。GCTB通常出现在人生第2至第4个10年(60%~75%),男女比例为1:1.2~1.5[2.5];多数病变位于长骨(75%~95%),其中大多(50%~65%)位于膝关节周围[1,2,8];其他易发部位包括桡骨远端、肱骨近端、腓骨、骶骨和椎体(<3%)[2,8];没有证据表明未融合骨骺中GCTB可从干骺端侵入骨骺[8]。
GCTB 80%为良性,局部复发率为20%~50%。约10%患者在复发时会出现恶性改变,良性病变也有1%~4%会出现肺部转移[5,9]。多数肺部转移的病理显示为良性,与原发GCTB形态类似。有些肺部转移患者可以生存很长时间,但是GCTB远处转移灶对化疗非常不敏感[2]。复发的GCTB可发生恶性改变,成为恶性破骨细胞瘤、纤维肉瘤或骨肉瘤,放疗会导致<1%的GCTB恶变为高度恶性肉瘤,或<15%的GCTB恶变为继发性恶性肿瘤[2,5,8]。
GCTB治疗一般首选手术治疗,术后复发率为15%~45%[8,13]。采用高速磨钻联合异体骨移植或骨水泥填充的病灶内手术,可使复发率可降至12%~14%[14,15]。局部复发的治疗包括再次病灶内刮除术或扩大切除术,以避免肿瘤进展而致残。扩大切除比病灶内刮除的复发率低(5%对25%),但是存在功能重建的难题[9]。如果明确肺部有转移灶,建议手术切除,80%患者预后较好[16]。约20%患者的转移灶属于持续缓慢生长型和快速生长型,如不予治疗可致死亡;也可考虑放射治疗。近期报道[17]显示,重度GCTB局部控制率可达到84%。但是,放疗的主要缺点在于潜在的肉瘤样恶变的高风险(5%~29%),尤其是在剂量超过45 Gy时[18]。
目前,GCTB药物治疗处于试验研究阶段,多数药物均基于疾病病因学理论。二磷酸盐具有抗骨破坏作用,已用于GCTB治疗。接受二磷酸盐治疗患者的复发率仅为4.2%,而对照组为30%[19]。接受干扰素-y的联合治疗可较好地控制GCTB,减少手术并发症[20]。根据长达6年的治疗效果,干扰素也被建议用于化疗无效的GCTB患者[21]。
2 狄诺塞麦
过去20多年中,二磷酸盐已成为良性和恶性骨病变的标准治疗,其中唑来膦酸为最常用药物[22]。一些研究显示,对调节骨细胞功能信号转导通路的认识,尤其是对RANKL在骨吸收过程信号转导通路中作用的认识,为抑制破骨细胞功能提供了潜在治疗靶点。
RANKL在基质细胞中的表达受很多内源激素和因子的调控,或上调RANKL表达,或降低骨保护素(OPG)表达(图3)。第一项检测RANKL抑制对破骨细胞功能作用的研究,采用的是重组OPG分子(AMGN0007)[23]。OPG在多种临床前肿瘤模型中均显示出抗细胞凋亡作用[24]。虽然这一发现与人类恶性肿瘤的相关性还不清楚,但OPG在癌症中的潜在负面影响却引发了对RANKL抑制剂另一种方法(抗体)的深入研究。
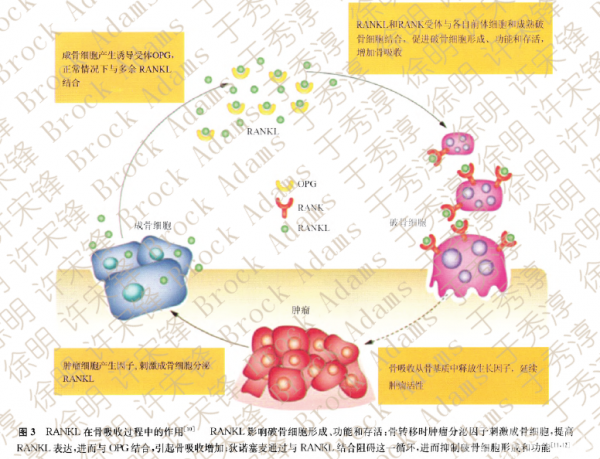
对RANKL的抑制不仅降低骨吸收,还会抑制骨转移进展。动物实验表明,RANKL与重组抗体OPG-Fc或RANK-Fc结合可使RANKL活性受抑制,进而破骨细胞形成[25]。此外,骨肉瘤鼠模型研究表明,抑制RANKL会阻碍人骨肉瘤细胞的侵袭和转移[26],减少肺转移[27]。
狄诺塞麦(商品名Xgeva,PROLIA)是一种人RANKL单克隆抗体(IgG2),具有很高的亲和性和特异性,作用并结合于RANKL,阻碍其与RANK在破骨细胞前体细胞和成熟细胞表面的结合,进而抑制破骨细胞分化、激活和存活。它抑制破骨细胞作用的骨组织破坏,为多发性骨髓瘤、溶骨性骨疾病以及乳腺癌骨转移、前列腺癌骨转移患者提供了快速持续的骨转换抑制[28,30];对RANK/RANKL的抑制,也可能杀灭GCTB中破骨细胞样巨细胞和相关单核细胞[7]。
对食蟹猴的研究表明,狄诺塞麦具有剂量依赖性抑制骨吸收和增加骨密度(BMD)的作用[31]。狄诺塞麦的第一项临床试验选择绝经后女性,单一剂量狄诺塞麦(3mg/kg)会引起快速、剂量依赖、持续的尿中N-末端肽(NTX)水平减少,治疗结束6个月后仍然有抑制作用[32]。对乳腺癌骨转移患者的研究表明,每4周120~180mg狄诺塞麦治疗可以提供最可靠、持续的N-末端肽抑制[30]。因此,评价疗效和耐受性最佳平衡的临床试验选用的狄诺塞麦治疗剂量为每4周120mg。
对252例绝经后伴早期乳腺癌女性的研究表明,狄诺塞麦组腰椎BMD值比对照组增加7.6%[33]。对接受去势治疗的1468例无转移前列腺癌患者的对照试验研究表明,接受36个月狄诺塞麦治疗可明显降低新生椎体骨折的发生率[34]。
发表于《Lancet》(柳叶刀)杂志上的一项研究表明,狄诺塞麦治疗不仅显著提高无骨转移生存率,而且明显延长首次骨转移时间和首次症状性骨转移时间[35]。在防止骨骼疾病发病率方面,一项多种肿瘤致骨转移患者的随机、Ⅱ期研究是第一项得出狄诺塞麦优于二磷酸盐的研究[29];接着,3项相似的Ⅲ期双盲注册研究先后完成[36-38],狄诺塞麦治疗延长了所有骨骼相关事件(SRE)如病理性骨折、需要放疗或手术、脊髓压迫的出现时间,骨吸收标志物水平在狄诺塞麦组比唑来膦酸组明显受抑制,狄诺塞麦总体疗效显著优于唑来膦酸。依据这些发现,美国于2010年、欧盟于2011年先后批准狄诺塞麦用于预防成年人实体肿瘤的骨骼并发症。2012年10月24日,英国国家卫生与临床规范研究院(NICE)颁布了狄诺塞麦用于预防成年人实体肿瘤骨转移骨骼相关事件指南[39]。
3 狄诺塞麦与GCTB
2000年有研究[3]指出,GCTB患者中狄诺塞麦对RANKL的抑制有可能抑制骨破坏过程、消灭巨细胞。破骨细胞样巨细胞和其前体细胞表达RANK受体激动剂,某些单核细胞(间充质细胞)表达RANKL。破骨细胞样巨细胞的聚集与间充质细胞表达RANKL有关,巨细胞是肿瘤侵袭性溶骨活性的根源[40]。狄诺塞麦已被证明通过RANK-RANKL信号通路抑制破骨细胞功能,因此也被认为可抑制GCTB中破骨细胞样巨细胞活性。
在了解GCTB中RANKL的作用后,研究者开始一项35例复发或难切除GCTB患者使用狄诺塞麦疗效验证的Ⅱ期临床试验[40]。狄诺塞麦用法为120mg皮下注射1次/4周,首月第8、15天追加一次;35例中有30例(86%)有肿瘤反应,再次活检病理明确的巨细胞几乎完全消失(所有病例),6个月后病情在影像学上稳定(15例中10例)。虽然这项验证性研究中未作疼痛或生活质量评估,数据仍然表明35例患者中有26例疼痛减轻或功能改善,9例影像学表现有骨修复。用药4周,氟脱氧葡萄糖一正电子发射计算机断层扫描(FDG-PET)出现代谢摄取的快速变化,提示出现治疗反应。最早在用药28天出现包括尿N-末端肽和血C-末端肽下降的骨代谢抑制,并一直延续整个研究过程。狄诺塞麦治疗的耐受性很好,未出现治疗相关严重不良反应。这项研究显示,狄诺塞麦可阻断复发或难切除GCTB患者中RANKL信号通路,使得肿瘤成分出现明显改变、骨破坏减少,显现出临床有效性。
近期一项Ⅱ期临床试验研究[41]选择无法手术或接受挽救手术的GCTB患者作为入组对象,结果表明狄诺塞麦耐受性好,疾病进展控制率达99%,降低了手术需求。还有报道[8]显示,接受狄诺塞麦治疗的GCTB患者中出现90%肿瘤坏死(图4)。这些均提示,对于侵袭性GCTB患者中不适合手术或手术部位较复杂者。术前狄诺塞麦治疗可以使手术操作更简单。
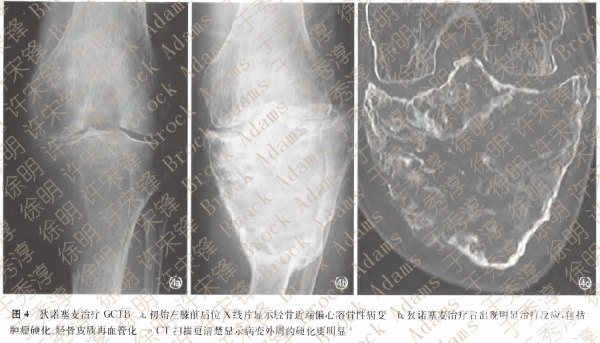
以上研究提示,狄诺塞麦可用于治疗复发性GCTB、无法手术救治的GCTB(如骶骨或脊柱(GCTB,或出现肺转移的多发病灶)、手术涉及关节切除、截肢、半骨盆离断或导致严重残疾的GCTB。
4 值得思考的问题
在已获批准的适应证范围应用狄诺塞麦后最常见不良反应有尿路感染、上呼吸道感染、呼吸困难、坐骨神经痛、白内障、便秘、腹泻、皮疹、多汗、四肢疼痛、低钙血症、低磷血症、牙齿脱落和颚骨坏死等[42]。有学者[40]建议每日口服钙剂500mg和维生素D400IU。以防止部分不良反应。
最近一项包含6142例骨转移患者的文献系统回顾研究[43]分析狄诺塞麦在降低骨骼相关事件方面的有效性和安全性。在降低骨骼相关事件发生率方面.狄诺塞麦优于唑来膦酸,可延缓骨骼相关事件出现时间;在降低总体发病率或总体不良反应方面,两者间无差异。系统回顾和网络Meta分析[44]表明,对于继发于实体肿瘤的骨转移,在延缓首次骨骼相关事件出现时间和降低首次、继发骨骼相关事件风险方面,狄诺塞麦组优于唑来膦酸、帕米磷酸和安慰剂租。一项包含25例骨质疏松患者的系统回顾研究[45]表明,与安慰剂和(或)阿仑膦酸钠相比,狄诺塞麦可更好、更持久地增加骨密度并降低骨转换标志物,主要风险是泌尿系感染和湿疹。
狄诺塞麦与静脉注射二磷酸盐相比较,其重要不良反应是引起颚骨坏死。有3项研究[36-38]。均表明狄诺塞麦组和唑来膦酸组均出现颚骨坏死,分别为1.8%和1.3%。治疗前3天,狄诺塞麦组和唑来膦酸组均出现包括发热、肌肉疼痛、骨骼疼痛的早期反应,分别为8.7%和约20%;虽然所有患者均口服钙剂和维生素D低钙血症发生率在狄诺塞麦组仍高于唑来膦酸组,分别为9.6%和5.0%[46]。令人放心的是,以上3项研究中狄诺塞麦组和唑来膦酸组感染事件发生率类似。两组在心血管不良反应、新发恶性病变或注射部位反应方面无显著差异,没有患者产生对抗狄诺塞麦的抗体。
显而易见,狄诺塞麦为早期、进展的或有症状的、曾复杂治疗过的GCTB,提供了前所未有的治疗上的选择。然而,治疗替代药物(包括狄诺塞麦)的风险效益平衡,依然是需要更多数据验证的复杂问题。比如巨大骶骨GCTB,手术或放疗需要长时问才能见到疗效;对于年轻患者。生殖问题是需要考虑的重要因素;怀孕对于狄诺塞麦治疗是禁忌证,但性腺及子宫也会因为骨盆区放疗受到影响;GCTB很少危及生命,被认为是一种慢性病,因此狄诺塞麦使用时间决定了治疗方法的选择。上述狄诺塞麦治疗GCTB的Ⅱ期临床研究[40]。没有说明脱组患者的情况。研究者所称颚骨坏死或符合颚骨坏死的口腔不良反应也没有详细阐明[47]。复发率、预测复发的生物标志物以及复发后治疗方法的选择也需要详细说明。该研究的随访不能够说明狄诺塞麦在GCTB治疗中的安全性和有效性[48];研究的局限性还包括特定病例的小样本量、研究时间短、单样本组设计。
另外一个问题是,狄诺塞麦是否有利于最终治疗。例如对于CampanacciⅢ级GCTB[49]。狄诺塞麦是否可降低手术程度,是否可降低最终手术后的复发率;如果GCTB患者需要终生接受狄诺塞麦,最佳治疗时间是什么;如果患者需要长期治疗,每月最佳给药方案是什么;狄诺塞麦对于骨骼发育的影响尚不清楚。更为普遍的是,对于接受狄诺塞麦长期治疗的年轻患者,长期安全性应包括针对骨密度的正规治疗措施。狄诺塞麦对于唧的这种作用究竟是暂时的还是长期的,或者可以实现最终控制,仍均未知。基质过度表达RANKL。基因的机制尚不清楚,GCTB可能代表了一种骨内正常成骨细胞和破骨细胞相互依存被破坏的病理反应。这种可能性的证据在于,未知反馈信号使基质细胞保持在一种不成熟的RANKL。表达状态。目前正在进行的临床试验(NCT00680992)纳入511例患者,纳入标准扩展到骨骼成熟的12岁及以上患者。此临床试验正试图解答这些问题,但是仍然需要开展随机临床试验研究。
最后,狄诺塞麦还可能为其他富含巨细胞的肿瘤样疾病,如下颌骨巨细胞修复性肉芽肿、腱鞘巨细胞瘤、软骨母细胞瘤、巨细胞丰富的毛囊肿瘤及巨细胞浸润相关恶性疾病提供临床借鉴。
5 结语
狄诺塞麦是一种高度有效和特异的RANKL。拮抗剂,是目前针对包括GCTB的疾病靶向转化研究的典范。在目前尚无其他选择的情况下,狄诺塞麦可通过抑制骨破坏控制患者症状和疾病发展。目前对狄诺塞麦用于原发性GCTB年轻患者的最佳用法和长期影响尚不清楚,有待进一步研究。期望在不久的将来,狄诺塞麦这一新方法可成为无法手术或术后功能不良GCTB患者的治疗选择之一。
参考文献(略)
选自《国际骨科学杂志》2013年11月第34卷第6期


 京公网安备11010502051256号
京公网安备11010502051256号